日常外来診療に基づいた総合内科のアプローチ
-- 臨床研修医のために --
アミロイドーシスの診断
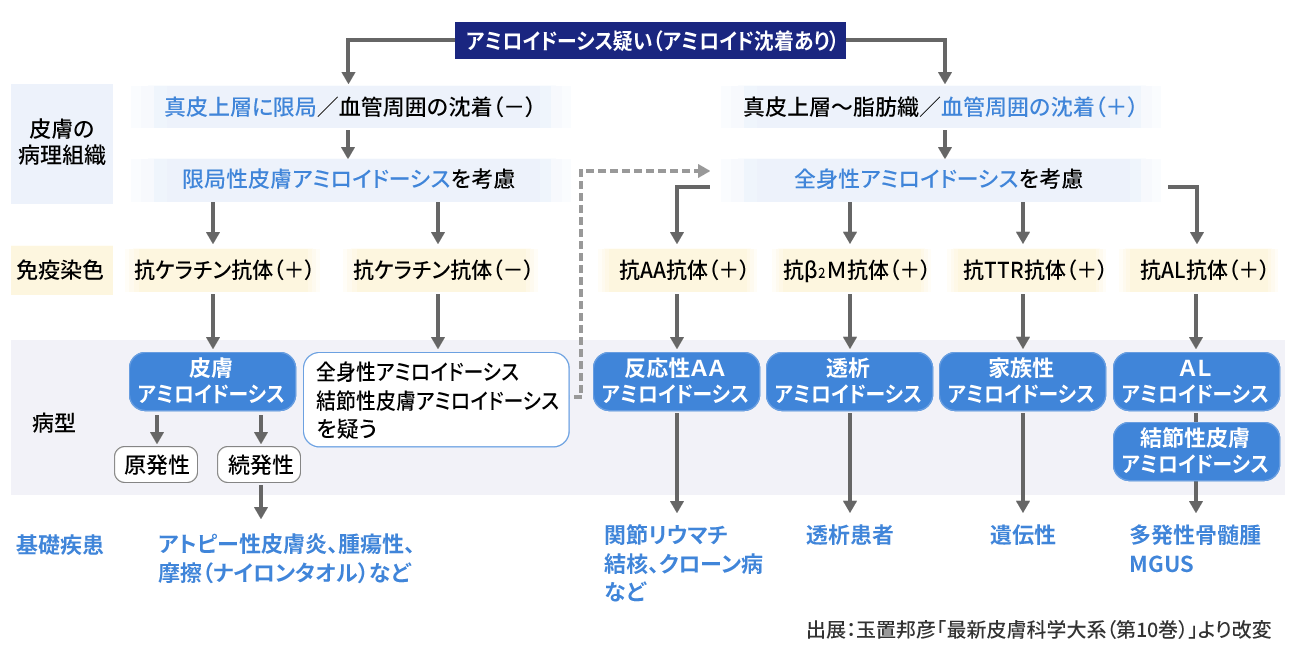
不溶性の異常タンパク質であるアミロイド線維が臓器や神経に沈着し機能障害を起こすのがアミロイドーシスです。
複数の臓器にアミロイドが沈着する全身性のもの(全身性アミロイドーシス)と、ある臓器に限局してアミロイドが沈着する限局性のもの(限局性アミロイドーシス)に分けられます。
中でも患者が多く、治療も難しい指定難病の全身性ALアミロイドーシスは新薬が登場し、治療が大きく変わろうとしています。
しかし、アミロイドーシスは特徴的な症状に乏しい上に稀な病気なため、確定診断に至るまで時間がかかるという問題があります。症状は沈着場所により異なるため多彩です。
教科書的には、心臓なら不整脈や心不全、腎臓ならネフローゼ症候群や腎不全、血管では血圧低下、神経ならしびれを引き起こします。これらの症状からアミロイドーシスを想起するのはなかなか難しく、こうした症状をみた場合に疑いの念を抱くことから始まります。
確定診断のためには、最終的に生検ということになります。
ALアミロイドーシスの早期診断のため
◎症状から推測する
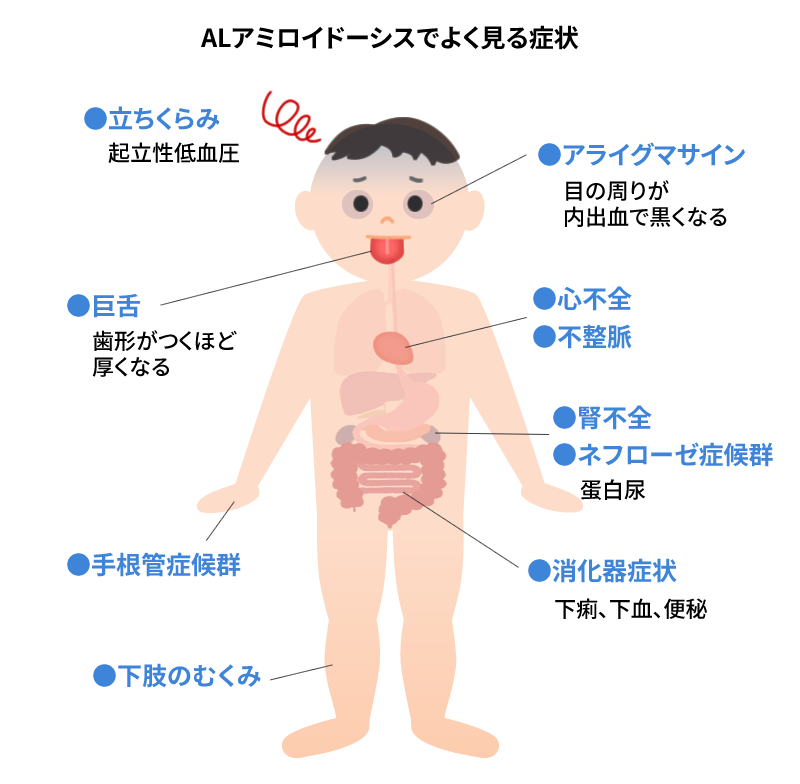
1.初期症状
初期には全身倦怠感、体重減少、浮腫、貧血などの非特異的症状があり、経過中にうっ血性心不全、蛋白尿、吸収不良症候群、末梢神経障害、起立性低血圧、手根管症候群、肝腫大、巨舌、皮下出血などを呈します。
2.高度の蛋白尿と下肢浮腫
ALアミロイドーシスに腎アミロイドーシスが生じる可能性は 60~70% で、大量の蛋白尿を来たすことが多く、その 1/3 はネフローゼ症候群レベルの蛋白尿と言われます。
診断時にすでに 20% の患者で腎機能低下が認められ、とくに高度の蛋白尿を伴っている症例に腎機能低下は多くみられます。
5~10% に蛋白尿のない腎機能障害例が存在しますが、そのような症例は糸球体より血管壁に優位にアミロイド線維が沈着しています。低蛋白血症や心不全により下肢浮腫だけでなく、胸水や心嚢水貯留を認めることがあります。
3.巨舌
巨舌は特徴的であり、約20%に認められ、消化管アミロイドーシスの診断に重要です。
アミロイドの沈着により舌はびまん性腫脹または結節状を呈し、板状に硬くなり、舌の運動は制限されます。表面の色は正常色、灰色ないしは淡黄色を呈し、舌側縁では歯圧痕がみられます。
全身性アミロイドーシスでは、舌だけでなく口唇、顎下腺などにも沈着し、口腔内多発性腫瘤、上頸部の腫脹などを認めることがあります。したがって、口腔内の巨舌、腫瘤、潰瘍、水疱、紫斑などさまざまな症状に対し、アミロイドーシスの可能性を考慮する必要があると思われます。
4.アライグマの眼サインとpinch purpura
アミロイドは血管壁にも沈着し、皮下出血や紫斑を来しますが、眼窩周囲に紫斑が出現した場合、「アライグマの眼サイン」と呼ばれます。同様に、軽い刺激で生じる紫斑は「pinch purpura」と呼ばれます。
これらの所見を認めたら、ALアミロイドーシスを疑う必要があります。
5.手足のしびれや末梢運動神経障害
ALアミロイドーシスの臨床診断時の症状は、心不全、腎障害に加え、起立性低血圧 17%、末梢神経障害 11%、手根管症候群 11%となっており、これらの神経症状の頻度をあわせると 40%近くとなります。特に手根管症候群は、心アミロイドーシスの心症状よりも早く認めるため、早期診断の重要なサインになります。
高齢の男性で両手にしびれ(特に親指、人差し指、中指にかけて)がある場合、アミロイドーシスが隠れている可能性が疑われます。
6.心不全や不整脈
心アミロイドーシスでは心不全により静脈の怒張、肝腫大、浮腫などを呈し、不整脈を認めることがあります。心臓へのアミロイドの沈着は予後不良因子と言われています。
7.消化器症状
消化管では、胃および十二指腸に沈着しやすいです。小腸や大腸に沈着すると、吸収不良症候群や下痢がみられます。血管へのアミロイドの沈着により血管の脆弱性が起こり、消化管出血が起こることもあります。
◎血液検査から推測できるか:すべては総蛋白/アルブミン比>2から始まる
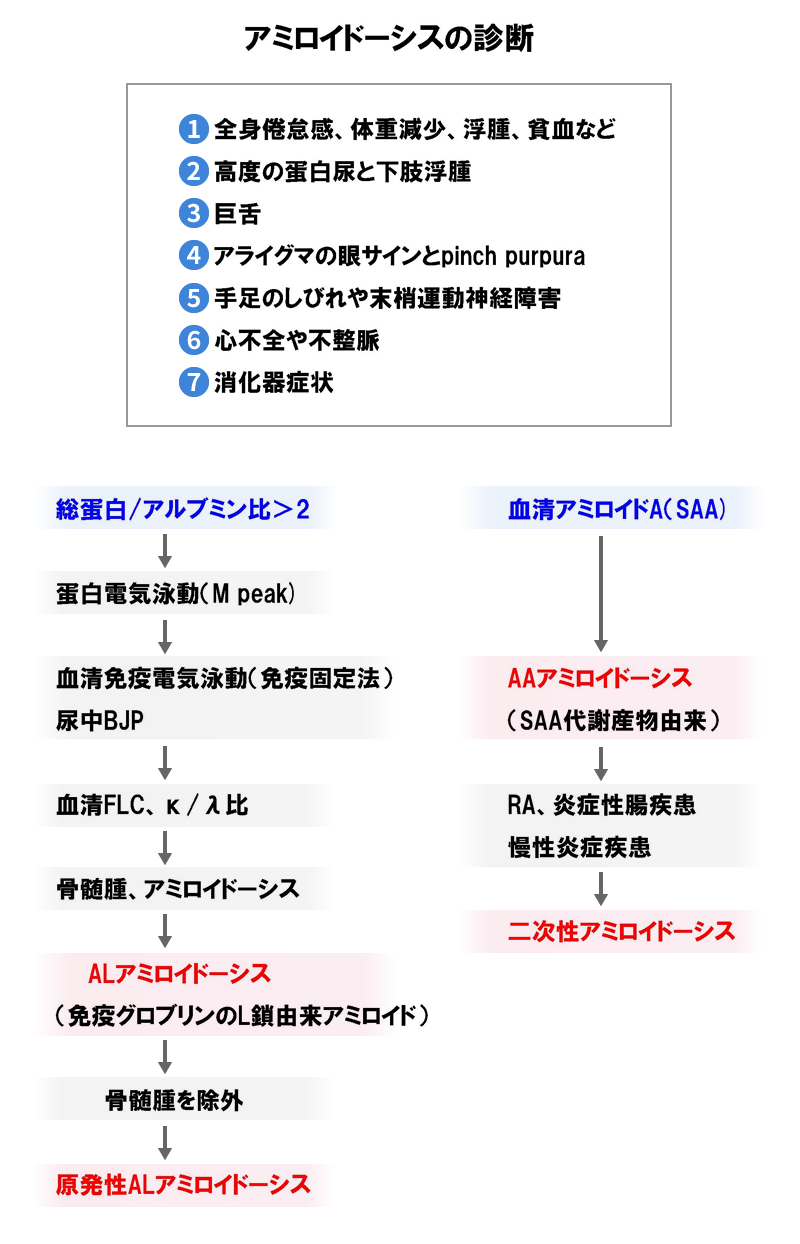
AL アミロイドーシスは多発性骨髄腫に伴うものとそうでない原発性アロイドーシスに大別されます。いずれも形質細胞の異常増殖が原因です。
したがって、ALアミロイドーシスの早期発見にはM蛋白をいかに検出するかがポイントになります。
多発性骨髄腫の時と同じように、M蛋白検出の第一歩は血清γ-グロブリンの増加です。そのため、総蛋白/アルブミン比に注意します。総蛋白/アルブミン比>2の場合、γ-グロブリンの増加の可能性が高くなります(ただし、低アルブミン血症は除いて考えます)。
次に、蛋白電気泳動を行い、ポリクローナルな増加かM peakが存在するか検討します。
ALアミロイドーシスの場合、蛋白電気泳動でM peakの確認を行い、血清免疫電気泳動(免疫固定法)でM蛋白の検索や尿中Bence Jones protein(BJP)の検索を行います。2011年9月より遊離軽鎖(free light chain:FLC)の測定が保険適用となりました。
本法はアミロイドーシスの98%の症例でFLCの検出が可能であり、高い検出感度を示します。
血清FLCは尿中BJPよりも感度が優れていることから、補助診断として有用であることが判明しています。血清FLCは予後因子としても重要であり、また、半減期が短いため、その測定は治療効果判定にも有用であるとされています。
単クローン性の形質細胞異常疾患(多発性骨髄腫、軽鎖沈着症、ALアミロイドーシスなど)では、血清FLCが高値になると共に、κ/λ比 が正常範囲から逸脱します。血清FLCは、血清免疫電気泳動の陰性のALアミロイドーシスでも 95~100% に陽性になり、尿・血清の両免疫電気泳動が陰性でも 86% に陽性になります。
ALアミロイドーシスの血清免疫電気泳動の陽性率は 69%、尿BJP陽性率は 83% とされていますが、FLCκ/λ比の異常率は 91% で、さらに、FLCκ/λ比異常と血清免疫電気泳動を組み合わせれば、 99% まで陽性率は上昇します(*1)。
ついで骨髄穿刺を行い、形質細胞のカウントやフローサイトメトリーによる表面マーカー解析により多発性骨髄腫を伴うかを鑑別します。多発性骨髄腫の約20%がALアミロイドーシスを合併しますが、最近の厚生労働省班会議のアミロイドーシス新分類(*2)では、骨髄腫を合併するかどうかは問われなくなりました。
*1 日本内科学会雑誌第100巻第5号 Ⅲ.パラプロテイン血症 2.アミロイドーシス 参照
*2 石原得博:アミロイドーシスの分類、アミロイドーシスの基礎と臨床、池田修一編.石原得博監修.初版、金原出版、東京、2005、 8―13

